








 Рейтинг: 4.8/5.0 (1530 проголосовавших)
Рейтинг: 4.8/5.0 (1530 проголосовавших)Категория: Инструкции
Повышенная чувствительность к активному веществу Диметилфумарат
Наиболее частыми побочными реакциями (заболеваемости ?10%) у пациентов, получавших пациентов Tecfidera были Промывка и желудочно-кишечные события (например. Как диарея, тошнота, боли в животе, боли в верхней части живота). Промывка и желудочно-кишечные события, как правило, начинаются в начале Курс лечения (в основном в течение первого месяца)
Дозировка и способ применения:
Лечение следует начинать под наблюдением врача, имеющего опыт в Имея лечение заболевания. Дозировка Начальная доза составляет 120 мг два раза в день. Через 7 дней лекарственных которой Рекомендуемая доза 240 мг два раза в день. Сокращение временного доза до 120 мг два раза в день может появление гиперемии и уменьшить желудочно-кишечные побочные эффекты. Рекомендуемая доза 240 мг два раза ежедневно должно быть возобновлено в течение месяца. Tecfidera следует принимать с едой (смотри раздел 5.2). Для Пациенты, которые страдают побочные эффекты при Чувствуя горячий или желудочно-кишечного тракта, прекратить прием из Tecfidera с пищей, чтобы улучшить переносимость (см разделы 4.4, 4.5 и 4.8). Пожилые люди Клинические исследования в Tecfidera включали ограниченное число пациентов в возрасте 55 лет и старше и не включает достаточное количество пациентов в возрасте 65 лет и старше один, для того, чтобы определить, реагирует ли они по-разному чем более молодых пациентов к препарату (см Раздел 5.2). В связи с действием препарата, нет теоретическое обоснование требуется корректировка дозы у пожилых пациентов
TECFIDERA 120MG отзывыГлавная • Библиотека • Дерматология • Лечение псориаза препаратом фумадерм, дозы, схема лечения, показания, противопоказания
Лечение псориаза препаратом фумадерм, дозы, схема лечения, показания, противопоказания Производные фумаровой кислотыВ 1994 г. команда клиницистов-исследователей во главе с Altmeyer сообщила о значительном антипсориатическом эффекте системного препарата, состоящего из смеси фумаратов, который был подтвержден в двойном слепом исследовании с большим количеством участников и с плацебо-контролем. Эти данные привели к одобрению фумаратного препарата (фумадерм), который впервые появился в Германии. Препарат имеется в двух вариантах дозировки.
Начинать лечение фумаратом рекомендуется, медленно повышая дозу ступенчатыми приращениями в течение нескольких недель. Повышение дозы зависит от терапевтической эффективности и ограничено индивидуальной переносимостью. Исходя из этих рекомендаций, максимальную ежедневную дозу фумарата в 1290 мг назначают ежедневно в 3 приема: утром, в обед и вечером. В большинстве случаев нет необходимости в назначении максимальной дозы (3 раза в день 2 таблетки фумадерма), эта доза представляет собой абсолютный максимум. Индивидуально подобранную дозу затем назначают как поддерживающую терапию. Производители препарата рекомендуют ограничиться циклом непрерывного назначения препарата продолжительностью 6 мес. Непрерывный прием фумаратов в течение длительного времени, даже нескольких лет, как наблюдается у многих пациентов, не изучался в клинических исследованиях с контролем.
Системное лечение фумаратами показано в случаях тяжелого псориаза:
Значительная клиническая реакция становится очевидной с 4-й по 6-ю недели. Примерно у 50-80% пациентов наблюдается значительное улучшение после лечения фумаратами. У оставшихся 25% пациентов это лечение оказывается неэффективным или невозможным из-за непредсказуемых побочных действий. Фумараты эффективны также при псориазе ногтей и псориатическом артрите.
Системное лечение фумаратами противопоказано при следующих обстоятельствах: тяжелые заболевания ЖКТ, включая поражения печени, все случаи нарушения функции почек, злокачественные новообразования, гематологические заболевания, возраст младше 18 лет, беременность, кормление и местное применение фамуровой кислоты и ее производных (в целом считается неэффективным).
К побочным реакциям относятся приливы (примерно у 30-50% пациентов), жалобы со стороны ЖКТ (примерно у 30% - тошнота, тенезмы, диарея), головная боль, усталость и головокружение. Приливы происходят в период от 30 мин до 6 ч после приема лекарства и продолжаются до 30 мин. Приливы особенно выражены в первые 2 недели (начальная фаза лечения фумаратами) и угасают позднее. Фармакокинетические и биохимические причины приливных реакций и соответствующих механизмов адаптации неизвестны. В небольшом количестве случаев сообщалось об обратимых нефрогенных побочных действиях, таких как нарушение функции почечных канальцев с протеинурией и повышение уровней креати-нина в сыворотке. Возможным воздействием лечения фумаратами на функцию почек вызвана такая мера предосторожности, как рекомендация выпивать в день минимум 1,5-2 л жидкости.
Лечение фумаратами требует регулярного лабораторного контроля следующих параметров: креатинин сыворотки, осадок и белок в моче, количество и дифференциация лейкоцитов, количество тромбоцитов и ферментов печени (глутамат-пируват-трансаминазы, гамма-глутамилтрансферазы и щелочной фосфатазы). Измерение этих параметров проводится как минимум каждые 14 дней в течение первых 3 месяцев лечения, а затем каждые 4 недели.
Отмена или уменьшение дозы при лечении фумаратами рекомендуются в следующих обстоятельствах:
Диметилфумарат* (Dimethyl fumarate*) - Иммуномодулятор, является производным фумаровой кислоты. Оказывает противовоспалительное и иммуномодулирующее действие.
Механизм терапевтического действия диметилфумарата при рассеянном склерозе изучен не до конца. В доклинических исследованиях было показано, что фармакодинамическое действие диметилфумарата, в основном, обусловлено активацией транскрипции ядерного фактора 2, подобного эритроидному деривату 2(Nrf2). Установлено, что диметилфумарат активирует Nrf2-зависимые антиоксидантные гены (например, NAD(P)H-дегидрогеназа, хинон оксидоредуктаза типа I; [NQO1]).
Также показано, что диметилфумарат и его основной метаболит, монометилфумарат, существенно снижают иммунную клеточную активность и последующее высвобождение провоспалительных цитокинов в ответ на индуцируемую воспалительную реакцию. У пациентов с псориазом диметилфумарат оказывает влияние на фенотип лимфоцитов за счет снижения образования провоспалительных цитокинов (ТН1, ТН17) и повышения продукции противовоспалительных цитокинов (ТН2). Терапевтическая активность диметилфумарата подтверждена при моделировании воспаления и нейровоспалительной травмы. В течение первого года применение диметилфумарата может сопровождаться снижением общего количества лимфоцитов в крови, в среднем на 30% от исходного значения, с последующей его стабилизацией.
Однократный прием диметилфумарата в дозе 240 мг или 360 мг не изменяет продолжительность интервала QTc .
В ходе клинических исследований в подгруппе пациентов с высокой активностью заболевания была продемонстрирована стабильная клиническая эффективность диметилфумарата в отношении снижения количества рецидивов заболевания, тогда как влияние на период времени до наступления трехмесячного устойчивого прогрессирования инвалидизации четко не установлено.
В фармакологии лекарственные препараты принято разделять на синонимы и аналоги. В состав синонимов входит одно или несколько одинаковых активных химических веществ, оказывающих лечебное воздействие на организм. Под аналогами понимаются лекарства, содержащие разные активные вещества, но предназначенные для лечения одних и тех же болезней.

Причиной инфекционных заболеваний являются вирусы, бактерии, грибы и простейшие. Течение болезней, вызванных вирусами и бактериями зачастую схожи. Однако различить причину заболевания — значит подобрать правильное лечение, которое поможет быстрее справиться с недомоганием и не навредит ребенку.

Некоторым людям знакома ситуация, когда ребенок часто и долго болеет банальной простудой. Родители водят его по врачам, сдаются анализы, пьются лекарства, и в результате ребенок уже состоит на учете у педиатра как часто болеющий. Истинные же причины частых респираторных заболеваний оказываются не выявленными.

Хламидийный уретрит часто встречается в практике врача уролога. Его вызывает внутриклеточный паразит Chlamidia trachomatis, обладающий свойствами, как бактерий так и вирусов, что зачастую требует продолжительных (long term antibiotic therapy) схем лечения антибактериальными средствами. Он способен вызывать неспецифическое воспаление уретры у мужчин и женщин.
Европейская комиссия по лекарственным средствам (EMA) одобрила пероральный препарат Текфидера (Tecfidera) в качестве терапии первой линии при рецидивирующе-ремиттирующем рассеянном склерозе. Производитель - компания Biogen - планирует начать поставки лекарственного средства в страны ЕС в ближайшие несколько недель.
В поддержку заявки препарата экспертам EMA были предоставлены данные двух масштабных клинических исследований DEFINE и CONFIRM, результаты которых свидетельствуют о способности ЛС эффективно подавлять клинические проявления заболевания, в том числе сокращать число пациентов, у которых отмечались обострения заболевания, снижать частоту обострений, замедлять инвалидизацию (по расширенной шкале оценки степени инвалидизации, EDSS), и формирование повреждений мозга.
Наиболее распространенными побочными эффектами Текфидеры были покраснения кожи, реакции со стороны желудочно-кишечного тракта.
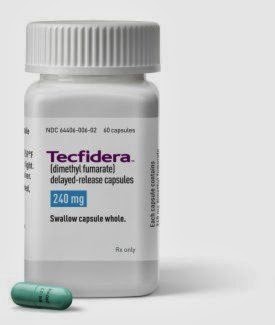
Текфидера (диметилфумарат - диметиловый эфир фумаровой кислоты) в форме пероральных капсул предназначен для лечения взрослых пациентов с рецидивирующе-ремиттирующим рассеянным склерозом.
В США Текфидера была зарегистрирована в марте 2013 года и с тех пор стала самым прописываемым лекарством для терапии рецидивирующего рассеянного склероза. Также в прошлом году препарат был одобрен на территории Канады и Австралии. К сентябрю 2013 год 35 тыс. больных по всему миру проходили терапию Текфидером.
Последние новости
По данным ВОЗ, отмеченные в Таиланде два случая рождения младенцев с микроцефалией, связанной с инфицированием вирусом Зика, стали первыми в Юго-Восточной Азии.

В последний месяц лета объем российского коммерческого рынка лекарственных препаратов составил 47,7 млрд долларов. Больше всего жители РФ покупали отечественные препараты – на их долю приходится 57%.

Брайан МакНамара станет новым руководителем GSK Consumer Healthcare вместо Эммы Уолмсли, которая 20 сентября была назначена генеральным исполнительным директором GSK.

По мнению Boehringer Ingelheim, онколитическая терапия, разрабатываемая в ViraTherapeutics, превосходит аналоги. Согласно результатам лабораторных экспериментов, новый препарат не провоцирует выработку вирусонейтрализующих антител, следовательно, снижается вероятность необходимости его повторного введения.

Больше всего рискуют девочки-подростки: в возрастной категории 15-19 лет вероятность депрессии может повышаться в 3 раза в зависимости от применяемого средства защиты от нежелательной беременности.


Tecfidera является пероральным препаратом содержащимся в капсулах. Принимается он два раза в день. Tecfidera ранее был известен как BG – 12 и является диметилфумаратом. Формулировка «Tecfidera» была специально разработана для использования препарата при лечении рассеянного склероза. Химически родственное соединение называется Fumaderm, оно было использовано в Германии при более высоких дозах для лечения острых вспышек псориаза. Хотя точный механизм действия до сих пор полностью не известен, считается что Tecfidera «ингибирует иммунные клетки и молекулы, имеет антиоксидантные свойства, которые могут защитить от повреждения головного и спинного мозга».
При исследованиях препарата и клинических испытаниях было обнаружено значительное снижение риска рецидивов у больных с РС. Доля рецидивов среди тех, кто принимал препарат 2 раза в день, составила 27%, по сравнению с 46% в группе принимающий плацебо. Так же, при помощи МРТ, было обнаружено значительное влияние на активность заболевания, снижение общего риска прогрессирующей инвалидности.
Влияние Tecfidera не изучено у людей в возрасте до 18 лет.
Tecfidera был одобрен FDA ( the U. S. Food and Drug Administration ) в 2013 году, в качестве терапии для взрослых людей с рецидивирующими формами рассеянного склероза.
Наиболее распространенными побочными эффектами на клинических испытаниях Tecfidera были покраснения (которые создавали ощущения тепла или зуд с красным румянцем на коже), проблемы с пищеварением (диарея, тошнота и боли в верхней части живота).
![]()
Еще раз день добрый всем тем, кто зашел на страничку моего блога. Справа сверху есть фото, мое фото. Меня зовут Илья и у меня демиелинизирующее заболевание ЦНС, что-то похожее на рассеянный склероз. Сейчас на момент 28-го числа 3-го месяца 2014 года у меня первая группа инвалидности. Зачем я создал этот блог? Вопрос довольно простой и ответ на него столь же прост. Создал потому что могу. Создал, потому что имею самое непосредственно отношение к рассеянному склерозу, инвалидности и жизни с инвалидностью в России. Какие цели преследую? Ну скорее всего самообразование и поиск выходов из сложившейся ситуации со здоровьем. Решение проблемы с рассеянным склерозом, т.е. с демиелинизирующим заболеванием. Ну и поиск злоу. тьфу единомышленников . И что же я буду делать? Эмс, наверно просто искать, и делится интересной информацией тут. Чуть позже может быть делится просто своим опытом жизни с данным заболеванием. А и да, вся информация дана в ознакомительных целях и представляет собой просто точку зрения автора, мою точку зрения. Которая, к слову, может очень сильно расходится с текущей реальностью.
![]()
Вспомогательные вещества. целлюлоза микрокристаллическая - 106.7 мг, кроскармеллоза натрия - 18.5 мг, кремния диоксид коллоидный - 2.2 мг, магния стеарат - 1.8 мг, триэтилцитрат - 9.5 мг, метакриловый кислоты-метилметакрилата сополимер (1:1) - 6.78 мг, дисперсия 30% метакриловой кислоты и этилакрилата сополимер [1:1] - 39.87 мг, симетикон - 0.2 мг, натрия лаурилсульфат - 0.3 мг, полисорбат 80 - 0.95 мг, тальк (микронизированный) - 17.1 мг.
Состав оболочки капсулы: корпус: желатин - 56.11 мг, титана диоксид (Е172) - 1.38 мг, краситель железа оксид желтый (Е172) - 0.09 мг, краситель бриллиантовый голубой FCF (Е133) - 0.01 мг; крышечка - желатин - 37.41 мг, титана диоксид (Е171) - 0.92 мг, краситель железа оксид желтый (Е172) - 0.06 мг, краситель бриллиантовый голубой FCF (Е133) - 0.01 мг.
Состав чернил черных (маркировка капсулы): шеллак - 24-27% (в/в), калия гидроксид - 0.05-0.1% (в/в), краситель железа оксид черный (Е172) - 24-28% (в/в).
14 шт. - блистеры (2) - конверты картонные (2) - пачки картонные.
Информация по препарату доступна только специалистам.
Войдите или Зарегистрируйтесь
Информация по препарату доступна только специалистам.
Войдите или Зарегистрируйтесь
— лечение взрослых пациентов с рецидивирующим ремитирующим рассеянным склерозом (важная информация о популяциях пациентов, для которых установлена эффективность препарата, изложена в разделе "Фармакодинамика").
Для приема внутрь.
Применение препарата необходимо начинать под наблюдением врача, имеющего опыт в лечении данного заболевания.
Капсулы или их содержимое не следует измельчать, делить, растворять, сосать, жевать, т.к. кишечнорастворимая оболочка микротаблеток, находящихся внутри капсул, препятствует раздражающему воздействию на слизистую оболочку ЖКТ.
Начальная доза составляет 120 мг 2 раза/сут. Через 7 дней дозу рекомендуется увеличить до 240 мг 2 раза/сут.
При возникновении нежелательных реакций со стороны ЖКТ или эпизодов «приливов» крови дозу препарата можно кратковременно снизить до 120 мг 2 раза/сут. В течение 1 мес рекомендуется возобновить прием препарата Текфидера в дозе 240 мг 2 раза/сут.
Препарат Текфидера следует принимать во время еды, что может способствовать уменьшению интенсивности "приливов" крови и реакций со стороны ЖКТ.
Особенности применения у отдельных групп пациентов
В клинических исследованиях препарата Текфидера принимало участие ограниченное число пациентов в возрасте 55 лет и старше. Также в исследования не было включено достаточное количество пациентов в возрасте 65 лет и старше для того, чтобы судить о различиях в переносимости препарата пожилыми и молодыми пациентами. Учитывая механизм действия активного вещества, с теоретической точки зрения, нет достаточных оснований для изменения дозы препарата при лечении пожилых пациентов.
Дети и подростки
Безопасность и эффективность применения препарата Текфидера у детей и подростков в возрасте от 10 до 18 лет не установлены в связи с отсутствием данных. Нет данных о лечении препаратом Текфидера рассеянного склероза у детей младше 10 лет.
Применение у пациентов с нарушениями функций почек и/или печени
Специальных исследований препарата Текфидера у пациентов с почечной и печеночной недостаточностью не проводилось. По данным клинико-фармакологических исследований изменение дозы препарата у данной категории пациентов не требуется. Лечение пациентов с тяжелой почечной и печеночной недостаточностью нужно проводить с осторожностью.
У пациентов, получавших лечение препаратом Текфидера, наиболее часто (у ≥10% пациентов) отмечались такие нежелательные лекарственные реакции (НЛР). как "приливы" крови и НЛР со стороны ЖКТ (в т.ч. диарея, тошнота, боль в животе, боль в верхней части живота). "Приливы" крови и НЛР со стороны ЖКТ чаще развиваются в начале терапии (в основном, в течение первого месяца). У пациентов, у которых развиваются подобные симптомы, "приливы" крови и желудочно-кишечные явления могут периодически возникать и в течение всего периода лечения. Наиболее часто причиной отмены препарата Текфидера (у >1% пациентов) были "приливы" крови (3%) и НЛР со стороны ЖКТ (4%).
НЛР представлены в соответствии с поражением органов и систем органов (MedDRA) и классификацией ВОЗ по частоте встречаемости: очень часто - ≥1/10 (>10%); часто - от ≥ 1/100 до <1/10 (от ≥ 1% до <10%); нечасто - от ≥1/1000 до <1/100 (от ≥ 0.1% до <1%); редко - от ≥1/10 000 до <1/1000 (от ≥ 0.01% до <0.1%); очень редко - <1/10 000 (<0.01%); частота неизвестна - не может быть оценена по имеющимся данным.
Инфекционные и паразитарные заболевании: часто - гастроэнтерит.
Со стороны крови и лимфатической системы: часто - лейкопения, лимфопения
Со стороны иммунной системы: нечасто - гиперчувствительность.
Со стороны нервной системы: часто - ощущение жжения.
Со стороны сосудов: очень часто - "приливы" крови; часто - ощущение жара, сопровождающееся учащенным сердцебиением.
Со стороны ЖКТ: очень часто - диарея, тошнота, боль в верхних отделах живота, боль в животе; часто - рвота, диспепсия, гастрит, желудочно-кишечное расстройство.
Со стороны кожи и подкожных тканей: часто - зуд, сыпь, эритема.
Со стороны почек и мочевыводящих путей: часто - протеинурия.
Общие расстройства и нарушения в месте введения: часто - ощущение жара.
Лабораторные и инструментальные данные: очень часто - кетонурия; часто - альбуминурия, повышение активности ACT, АЛТ, лейкопения.
"Приливы" описываются пациентами как ощущения прилива крови к коже или ощущения жара, но могут включать и другие проявления (например, ощущения тепла, покраснения, покалывания, жжения). В ходе плацебо-контролируемых исследований отмечалось увеличение частоты возникновения эпизодов "приливов" крови (34% по сравнению с 4%) и ощущение жара (7% но сравнению с 2%), соответственно, у пациентов, получавших препарат Текфидера, по сравнению с пациентами, получавшими плацебо. В большинстве случаев интенсивность "приливов" отмечалась пациентами как слабо или умеренно выраженная. Случаи тяжелого течения "приливов", которые проявлялись распространенной эритемой, кожной сыпью и/или зудом кожи, наблюдались менее чем у 1% пациентов, принимавших препарат Текфидера.
НЛР со стороны ЖКТ
У пациентов, получающих препарат Текфидера, по сравнению с пациентами, получавшими плацебо, частота НЛР со стороны ЖКТ была выше (например, диарея [14% по сравнению с 10%], тошнота [12\% по сравнению с 9%], боль в верхних отделах живота [10% по сравнению с 6%]. боль в животе [9% по сравнению с 4%], рвота [8% по сравнению с 5%] и диспепсия [5% по сравнению с 3%]). В большинстве случаев интенсивность симптомов со стороны ЖКТ отмечалась пациентами как слабо или умеренно выраженная. Тяжелые HЛР со стороны ЖКТ. в т.ч. гастроэнтерит и гастрит, наблюдались в 1% случае у пациентов, принимавших препарат Текфидера.
Активность "печеночных" трансаминаз
В ходе плацебо-контролируемых исследований наблюдались случаи повышения активности "печеночных" трансаминаз. У большинства пациентов активность "печеночных" трансаминаз не превышала верхние границы нормы (ВГН) данных показателей более чем в 3 раза. Повышение активности "печеночных" трансаминаз у пациентов, получавших лечение препаратом Текфидера, по сравнению с пациентами, получавшими плацебо, наблюдалось, преимущественно, в течение первых 6 мес терапии. Повышение активности АЛТ и ACT в 3 и более раз от ВГН отмечены, соответственно, у 5% и 2% пациентов, получавших плацебо, и у 6% и 2% пациентов, получавших препарат Текфидера. Случаев одновременного повышения активности "печеночных" трансаминаз в 3 и более раз и общего билирубина в 2 и более раз от BГН не наблюдалось. Повышение активности "печеночных" трансаминаз послужило причиной отмены терапии менее чем у 1% пациентов как в группе пациентов, принимавших препарат Текфидера, так и плацебо.
НЛР со стороны почек и мочевыводящих путей
Протеинурия наблюдалась чаще у пациентов, принимавших препарат Текфидера (9%) по сравнению с плацебо (7%). Общая частота HЛP со стороны почек и мочевыводящих путей не отличалась у пациентов, получавших препарат Текфидера или плацебо. Случаев тяжелой почечной недостаточности не зарегистрировано. Доля пациентов с протеинурией ("1+" и выше) была сопоставима на фоне применения препарата Текфидера (43%) и плацебо (40%). Как правило, выраженность протеинурии не нарастала. По сравнению с плацебо, у пациентов, получавших препарат Текфидера. скорость клубочковой фильтрации (СКФ) повышалась, в т.ч. у пациентов, у которых протеинурия составляла ≥1+ при 2 последовательных исследованиях.
НЛР со стороны крови и лимфатической системы
У большинства пациентов (>98%) не было выявлено отклонений общего числа лимфоцитов в крови до применения препарата Текфидера в рамках плацебо-контролируемых исследований. После начала лечения препаратом отмечено снижение общего числа лимфоцитов в течение первого года с последующей их стабилизацией. В среднем, общее число лимфоцитов снижалось примерно на 30% от исходного значения. При этом медиана и среднее число лимфоцитов оставались в пределах нормы. Общее число лимфоцитов <0.5×10 9 /л наблюдалось менее, чем у 1% пациентов, получавших плацебо, и у 6% - получавших препарат Текфидера. Количество лимфоцитов <0.2×10 9 /л отмечено у 1 пациента, принимавшего препарат Текфидера, но не наблюдалось в группе плацебо. В клинических исследованиях, как контролируемых, так и неконтролируемых, у 2% пациентов снизилось число лимфоцитов до значений <0.5×10 9 /л на период длительностью не менее 6 мес. У большинства из этих пациентов снижение числа лимфоцитов оставалось на том же уровне при продолжении терапии. У пациентов, принимавших препарат Текфидера или плацебо, частота инфекционных заболеваний не отличалась, и составляла, соответственно, 60% и 58%, в т.ч. и тяжелых 2% и 2%. Нe наблюдалось более частого развития инфекционных заболеваний, в т.ч. серьёзных, у пациентов е количеством лимфоцитов <0.8×10 9 /л или <0.5×10 9 /л. Отмечен случай прогрессивной мультифокальной лейкоэнцефалопатии на фоне выраженной и длительной лимфопении. В первые 2 мес терапии у пациентов отмечалась транзиторная эозинофилия.
Другие изменения лабораторных показателей
В ходе плацебо-контролируемых исследований у пациентов, которые получали препарат Текфидера, кетонурия (1+ и выше) определялись чаще (45%), чем в группе плацебо (10%). Клиническая значимость данного наблюдения не определена.
Концентрация 1,25-дигидроксивитамина D в крови снижалась у пациентов, принимавших препарат Текфидера или плацебо, соответственно, в среднем на 25% и 15% от исходного значения через 2 года лечения, а концентрация паратгормона (ПТГ) повышалась, соответственно, в среднем на 29% и 15%. Средние значения обоих показателей оставались в пределах нормы.
Противопоказания к применению
— повышенная чувствительность к активному веществу или любому вспомогательному компоненту препарата;
— детский возраст до 18 лет (в связи с отсутствием клинических данных).
— с исходно низким общим количеством лимфоцитов крови (<0.5×10 9 /л);
— с тяжелыми нарушениями функции почек (КК <30 мл/мин/1.73 м 2 ) или печени (класс С по шкале Чайлд-Пью) (отсутствие клинических данных);
— с заболеваниями ЖКТ при беременности и в период грудного вскармливания (в связи с ограниченными данными-см. "Применение при беременности и в период грудного вскармливания");
— при одновременном применении противоопухолевых и иммуносупрессивных препаратов.
Применение при беременности и кормлении грудью
Данные о применении диметилфумарата у беременных женщин ограничены. В исследованиях на животных было показано токсическое действие препарата на репродуктивную систему. Не рекомендуется применять препарат Текфидера при беременности и у женщин репродуктивного возраста, не использующих надежные методы контрацепции. Препарат Текфидера можно назначать во время беременности только в случае крайней необходимости, когда потенциальная польза для матери превышает возможный риск для плода.
Неизвестно, проникает ли диметилфумарат или его метаболиты в грудное молоко человека, поэтому нельзя исключить риск для новорожденных детей и младенцев. Решение о прекращении грудного вскармливания или отмене терапии препаратом Текфидера должно быть принято после тщательной оценки соотношения пользы для матери и риска для ребенка.
Данные о влиянии препарата Текфидера на фертильность человека отсутствуют. Результаты доклинических исследований не выявили повышенного риска снижения фертильности на фоне применения диметилфумарата.
Применение при нарушениях функции печени
С осторожностью применять препарат пациентам с тяжелыми нарушениями функции печени (класс С по шкале Чайлд-Пью).
Применение при нарушениях функции почек
С осторожностью применять препарат пациентам с тяжелыми нарушениями функции почек (КК<30 мл/мин/1.73 м 2 ).
Применение у детей
Противопоказано применение препарата детям и подросткам в возрасте до 18 лет (в связи с отсутствием клинических данных).
Применение у пожилых пациентов
Коррекции дозы не требуется.
Применение препарата Текфидера может сопровождаться снижением общего количества лимфоцитов в крови. Препарат Текфидера не изучали у пациентов, которые исходно имели сниженное количество лимфоцитов, поэтому следует соблюдать осторожность при применении препарата у таких пациентов. До начала лечения следует оценить результаты развернутого клинического анализа крови пациента (включая подсчет числа лимфоцитов, давностью не более 6 мес). Повторную оценку анализа крови (включая подсчет числа лимфоцитов) рекомендуется провести через 6 мес, а затем регулярно проводить исследование крови каждые 6-12 мес с учетом клинических показаний.
В клинических исследованиях у 2% пациентов снизилось число лимфоцитов до уровня <0.5×10 9 /л на период длительностью не менее 6 мес. У большинства из этих пациентов такое низкое количество лимфоцитов оставалось и при продолжении терапии. Необходимо рассмотреть целесообразность перерыва в приеме препарата Текфидера у пациентов со снижением числа лимфоцитов <0.5×10 9 /л, сохраняющимся на протяжении 6 мес. Подсчет числа лимфоцитов следует осуществлять регулярно до нормализации показателя. Изменения отдельных функциональных показателей печени и почек наблюдались в клинических исследованиях у пациентов, принимающих препарат Текфидера. Клиническая значимость этих изменений не известна. Рекомендуется контролировать функцию почек (например, по результатам исследования азота мочевины и креатинина крови, общего анализа мочи) и печени (например, определение активности АЛТ и ACT) до лечения и спустя 3 и 6 мес от начала лечения, а затем - каждые 6-12 мес в зависимости от клинических показаний.
Тяжелые нарушения функций почек и печени
В связи с тем. что препарат Текфидера не изучали у пациентов с тяжелыми нарушениями функций почек и печени, применять его у данной категории пациентов следует с осторожностью.
Заболевания ЖКТ в период выраженного обострения
В связи с тем, что препарат Текфидера не изучали у пациентов с выраженными обострениями заболеваний ЖКТ, применять его у данной категории пациентов следует с осторожностью.
В клинических исследованиях 34% пациентов, получающих препарат Текфидера, отмечали "приливы" крови. В большинстве случаев интенсивность "приливов" оценивалась как легкая или умеренно тяжелая.
По данным клинических исследований у 3 из 2560 пациентов, применявших препарат Текфидера, симптомы "приливов" характеризовались как тяжелые. Возможно они были обусловлены реакциями гиперчувствительности или анафилактоидными реакциями. Указанные реакции не носили жизнеугрожающего характера, однако стали причиной госпитализации пациентов. Врачи и пациенты должны быть осведомлены о возможной причине развития у пациентов выраженных симптомов "приливов".
Частота инфекционных заболеваний, в т.ч. тяжелого течения, была сопоставима у пациентов, принимавших препарат Текфидера и плацебо, соответственно, 60% или 58%, и 2% или 2%. Не наблюдалось повышения частоты тяжелых инфекций у пациентов с количеством лимфоцитов в крови менее 0.8×10 9 /л или менее 0.5×10 9 /л. У пациентов, получающих препарат Текфидера, в течение первого года лечения было отмечено снижение общего количества лимфоцитов примерно на 30% от исходного значения с последующей стабилизацией. Среднее количество лимфоцитов при этом оставалось в пределах нормальных значений. Снижение числа лимфоцитов до уровня <0.5×10 9 /л отмечено у <1% пациентов в группе плацебо и у 6% пациентов в группе препарата Текфидера.
В клинических исследованиях (контролируемых и неконтролируемых) у 2% пациентов снизилось число лимфоцитов до уровня <0.5×10 9 /л на период не менее 6 мес. У большинства из этих пациентов снижение числа лимфоцитов оставалось на таком же уровне при продолжении терапии. Необходимо рассмотреть целесообразность перерыва в приеме препарата Текфидера у пациентов со снижением числа лимфоцитов <0.5×10 9 /л, сохраняющимся на протяжении 6 мес. Подсчет числа лимфоцитов следует осуществлять регулярно до нормализации показателя. При развитии у пациента тяжелой инфекции следует рассмотреть необходимость перерыва в лечении препаратом Текфидера. Для решения вопроса о возобновлении лечения следует оценить соотношение пользы и риска для пациента. Пациенты, получающие препарат Текфидера. обязаны информировать врача о возникновении симптомов любой возможной инфекции. Пациентам с тяжелым течением инфекционного заболевания не следует применять препарат Текфидера до их излечения.
Влияние на способность управления транспортными средствами и другими механизмами
Влияние на способность управления транспортными средствами и другими механизмами не изучено.
О случаях передозировки препарата Текфидера не сообщалось.
Не проводилось исследований препарата Текфидера в комбинации с противоопухолевыми или иммуносупрессивными препаратами, поэтому при одновременном применении данных лекарственных препаратов следует проявлять осторожность. Сопутствующее кратковременное в/в применение ГКС для профилактики рецидивов рассеянного склероза в ходе клинических исследований препарата Текфидера не сопровождалось клинически значимым увеличением частоты развития инфекций. Применение вакцин в период лечения препаратом Текфидера не изучалось. Сведения о возможном снижении эффективности каких-либо вакцин на фоне применения препарата Текфидера отсутствуют. Живые вакцины могут повышать риск инфекционных заболеваний, поэтому не должны применяться у пациентов, получающих препарат Текфидера, за исключением случаев, когда потенциальная польза вакцинации превышает риск ее проведения.
Во время терапии препаратом Текфидера следует избегать одновременного применения других производных фумаровой кислоты (как для местного, так и для системного применения).
Перед попаданием в системный кровоток диметилфумарат метаболизируется в организме человека при участии эстераз. Далее в метаболизме участвуют ферменты цикла трикарбоновых кислот без участия изоферментов системы цитохрома Р450. В исследованиях in vitro не было выявлено потенциального риска ингибирования и индукции изоферментов системы цитохрома Р450, так же как при оценке влияния Р-гликопротеина и изучении связывания диметилфумарата и монометилфумарата (основной метаболит диметилфумарата) с белками плазмы крови.
Установлено, что интерферон бета-1а для в/м введения и глатирамера ацетат. часто применяемые для лечения рассеянного склероза, не оказывали влияния на фармакокинетический профиль диметилфумарата.
Прием в течение 4 дней 325 мг не кишечнорастворимой лекарственной формы ацетилсалициловой кислоты (или аналога) за 30 мин до приема препарата Текфидера не оказывал влияния на фармакокинетический профиль препарата Текфидера, но приводил к снижению частоты и тяжести "приливов" крови у здоровых добровольцев. Тем не менее, длительное применение ацетилсалициловой кислоты для лечения "приливов" крови не рекомендуется. Следует учитывать потенциальные риски применения ацетилсалициловой кислоты до принятия решения о совместном назначении с препаратом Текфидера.
Одновременное применение препарата Текфидера с лекарственными средствами, обладающими нефротоксическим действием (такими как аминогликозиды, диуретики, НПВС или препараты лития) может повышать риск НЛР со стороны почек и мочевыводящих путей (например, вызывать протеинурию) (см. "Побочное действие").
Употребление умеренного количества алкоголя не изменяет экспозицию препарата Текфидера и не сопровождается повышением частоты НЛР. Напротив, употребление большого количества неразбавленных крепких алкогольных напитков (более 30 об%) может приводить к увеличению скорости растворения препарата Текфидера и, как следствие, повышению частоты НЛР со стороны ЖКТ.
Результаты исследований in vitro возможной индукции изоферментов системы цитохрома Р450 не обнаружили взаимодействия между препаратом Текфидера и пероральными контрацептивами. Исследования in vivo по изучению взаимодействия с пероральными контрацептивами не проводились. Несмотря на то, что взаимодействие между препаратом Текфидера и пероральными контрацептивами маловероятно, следует рассмотреть возможность применения негормональных контрацептивных средств на фоне лечения препаратом Текфидера.
Условия отпуска из аптек
Препарат отпускается по рецепту.
Спонсор исследований: Biogen Idec
Названия исследований: DEFINE, CONFIRM, EXPLORE
Стадия разработки: FDA (Государственное управление по контролю за качеством пищевых продуктов и лекарственных препаратов, США) одобрило заявку компании-производителя на утверждение BG-12 в качестве препарата для лечения ремиттирующего рассеянного склероза в марте 2013 года
Название препарата: BG-12
Другие названия: BG00012, диметил фумарат, Панаклар (Panaclar), Текфидера (Tecfidera).
Тип течения РС: Рецидивирующе-ремиттирующий рассеянный склероз (РС)
приливы и ощущения жара;
понос, тошнота, боль в животе;головная боль
В феврале 2012 года компания-производитель подала заявку в FDA (Государственное управление по контролю за качеством пищевых продуктов и лекарственных препаратов, США) на утверждение BG-12 как препарата для лечения пациентов с рецидивирующим рассеянным склерозом.
Механизм действия до конца не изучен, но доклинические исследования показали, что BG-12 может оказывать сложное нейропротекторное и противовоспалительное действие, действуя посредством активизации NRF-2 фактора. Активация NRF-2 фактора защищает от окислительного стресса, защищает гематоэнцефалический барьер и поддерживает сохранение целостности миелиновых оболочек в центральной нервной системе.
BG-12 принимают в виде таблеток два или три раза в день.
Результаты проведенных исследований
Во II фазе клинического исследования препарата изучалось воздействие различных доз BG-12 по сравнению с плацебо у пациентов с рецидивирующе-ремиттирующим РС в течение 24 недель лечения. BG-12 значительно сократил МРТ активность РС. Наблюдалось 32%-ное снижение частоты рецидивов, однако эти данные не могут быть значимыми, так как это измерение не было включено в протокол исследования. Результаты двух исследований III фазы были обнародованы в 2011 году.
ИсследованиеDEFINE— Определение эффективности и безопасности перорального приема препарата BG-12 при ремиттирующем РС.
В этом двухлетнем двойном слепом плацебоконтролируемом исследовании приняли участие 1324 пациента. Пациенты были распределены в три группы: BG-12 (240 мг.) 3 раза в день, BG-12(240 мг.) 2 раза в день и плацебо. Результаты исследования показали снижение количества рецидивов по сравнению с группой плацебо на 53% в группе, получавшей активный препарат два раза в день и на 48% BG-12 три раза в день. Кроме того, риск прогрессииинвалидности через три месяца снижался на34% и38% соответственно .
Результаты этого исследования были представлены на конференции ECTRIMS / ACTRIMS 2011 которая состоялась в Амстердаме 19-22 октября 2011 года (тезисы 95, P1071, P831, P994)
Исследование CONFIRM - исследование эффективности и безопасности приема BG00012 в сравнении с Копаксоном при ремиттирующем РС.
Это исследование III фазы КИ с 1232 участниками было похоже на исследование DEFINE. однако, для сравнения, в этом исследовании участники были рандомизированы и в группу, которая получала глатирамера ацетат (Копаксон) .
BG-12 снизил количество рецидивов на 44% в группе получавшей активный препарат два раза в день и на 51% в группе, получавшей активный препарат три раза в день. по сравнению с плацебо. В отличие от глатиромерацетата, эффективность которого в этом исследовании определялась как уменьшение частоты рецидивов на 29%. Пресс-релиз компании
Во время клинических исследований прием BG-12 не сопровождался развитием серьезных нежелательных осложнений и инфекций. Наиболее распространенными побочными эффектами были:
Исследование EXPLORE. Оценка эффективности комбинированной терапии BG-12.
Целью II фазы КИ является оценка безопасности и переносимости комбинированной терапии BG-12 и терапии бета-интерферонами или глатиромера ацетатом (КРАБ). В исследовании примут участие до 100 человек, у которых подтверждена активность заболевания, несмотря на получение монотерапии КРАБами, по крайней мере в течение года. Предполагаемая дата завершения исследования — июнь 2012 года. Более подробная информация о данном исследовании.
Изучение долгосрочной безопасности и эффективности монотерапии BG00012 ремиттирующего рассеянного склероза
Целью исследования является подтверждение результатов исследований по оценке долгосрочной эффективности и безопасности BG-12. В нем примут участие пациенты, принявшие участие в исследованиях CONFIRM и DEFINE. Предполагаемая дата завершения КИ — июнь 2016. Более подробная информация о данном исследовании.
Kappos L, et al.
Efficacy and safety of oral fumarate in patients with relapsing-remitting multiple sclerosis: a multicentre, randomised, double-blind, placebo-controlled phase IIb study
Lancet 2008;372:1463-1472.
Kappos L, et al.
Effect of BG-12 on contrast-enhancing lesions in patients with relapsing-remitting multiple sclerosis: subgroup analyses from the phase 2b study.
Multiple Sclerosis 2011 Aug 30. [Epub ahead of print]
MacManus DG, et al.
BG-12 reduces evolution of new enhancing lesions to T1-hypointense lesions in patients with multiple sclerosis.
J Neurol. 2011 Mar;258(3):449-56.