








 Рейтинг: 4.2/5.0 (1845 проголосовавших)
Рейтинг: 4.2/5.0 (1845 проголосовавших)Категория: Бланки/Образцы
Продукты и услуги Информационно-правовое обеспечение ПРАЙМ Документы ленты ПРАЙМ Приказ Министерства здравоохранения и социального развития РФ от 29 сентября 2011 г. N 1087н "О внесении изменения в Порядок оказания медицинской помощи больным дерматовенерологического профиля, утвержденный приказом Министерства здравоохранения и социального развития Российской Федерации от 16 марта 2010 г. N 151н"
 Обзор документа
Обзор документа
22 декабря 2011
Внести изменения в Порядок оказания медицинской помощи больным дерматовенерологического профиля, утвержденный приказом Министерства здравоохранения и социального развития Российской Федерации от 16 марта 2010 г. N 151н (зарегистрирован Министерством юстиции Российской Федерации 13 апреля 2010 г. N 16881), согласно приложению .
Зарегистрировано в Минюсте РФ 30 ноября 2011 г.
Регистрационный N 22459
Приложение
к приказу Министерства здравоохранения и
социального развития РФ
от 29 сентября 2011 г. N 1087н
1. В пункте 1 слова "в организациях государственной и муниципальной систем здравоохранения" заменить словами "в организациях, оказывающих медицинскую помощь по профилю "дерматовенерология".
2. В пункте 2 слова "в соответствии с приложениями N N 1 - 7" заменить словами "в соответствии с приложениями N N 1 - 9".
3. Пункт 6 изложить в следующей редакции:
"6. Специализированную медицинскую помощь больным дерматовенерологического профиля оказывают:
центр специализированных видов медицинской помощи;
амбулаторно-поликлиническое, стационарное отделение медицинской организации, оказывающей специализированную помощь больным дерматовенерологического профиля;
клиника (отделение) научной или образовательной организации.".
4. В приложении N 1:
а) наименование дополнить примечанием "*" следующего содержания:
"*Рекомендуется использовать данное положение при организации деятельности кожно-венерологических диспансеров, центров специализированных видов медицинской помощи, лепрозориев.";
б) пункт 2 изложить в следующей редакции:
"2. Кожно-венерологический диспансер (далее - Диспансер) оказывает специализированную медицинскую помощь больным дерматовенерологического профиля.
Диспансер субъекта Российской Федерации создается органом исполнительной власти субъекта Российской Федерации в области здравоохранения.";
в) пункт 4 изложить в следующей редакции:
"4. Диспансер субъекта Российской Федерации возглавляет руководитель, назначаемый на должность и освобождаемый от нее органом исполнительной власти субъекта Российской Федерации в области здравоохранения.".
г) пункт 7 изложить в следующей редакции:
"7. Для обеспечения функций Диспансера в его структуре рекомендуется предусматривать:
стационарное отделение, в том числе дневной стационар;
отделение (кабинет) физиотерапевтических методов лечения;
подростковый специализированный центр профилактики и лечения инфекций, передаваемых половым путём;
отделение для проведения медицинских осмотров;
организационно-методический отдел (кабинет);
отдел программно-информационной поддержки;
другие отделения в соответствии с производственной необходимостью.".
5. В приложении N 3:
а) наименование изложить в следующей редакции:
"Положение об организации деятельности амбулаторно-поликлинического отделения медицинской организации, оказывающей специализированную медицинскую помощь больным дерматовенерологического профиля";б) пункт 1 изложить в следующей редакции:
"1. Настоящее Положение определяет организацию деятельности амбулаторно-поликлинического отделения медицинской организации, оказывающей специализированную медицинскую помощь больным дерматовенерологического профиля.";
в) абзац второй пункта 3 изложить в следующей редакции:
"больных с заболеваниями кожи и подкожной клетчатки, косметологическими дефектами кожи, инфекциями, передаваемыми половым путем, и ассоциированными заболеваниями, направляемых врачами-терапевтами участковыми, врачами общей практики (семейными врачами) и врачами других специальностей, а также обратившихся самостоятельно;".
6. В приложении N 4:
а) наименование изложить в следующей редакции:
"Положение об организации деятельности стационарного отделения медицинской организации, оказывающей специализированную медицинскую помощь больным дерматовенерологического профиля";б) пункт 1 изложить в следующей редакции:
"1. Настоящее Положение определяет организацию деятельности стационарного отделения медицинской организации, оказывающей специализированную помощь больным дерматовенерологического профиля (далее - Отделение).".
7. В приложении N 6:
а) наименование изложить в следующей редакции:
"Рекомендуемые штатные нормативы персонала медицинских организаций, оказывающих специализированную медицинскую помощь больным дерматовенерологического профиля";наименование изложить в следующей редакции:
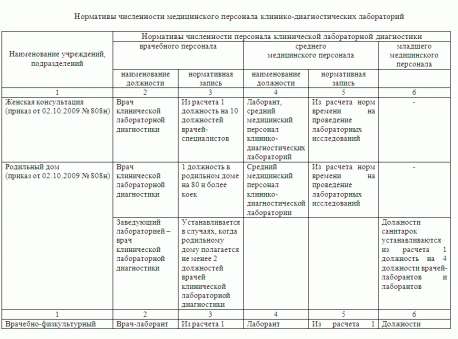
"1. Рекомендуемые штатные нормативы медицинского персонала стационарного отделения медицинской организации, оказывающей специализированную медицинскую помощь больным дерматовенерологического профиля";"Медицинская сестра (палатная)
8. Дополнить приложениями N 8 и N 9 следующего содержания:
"Приложение N 8
к Порядку оказания
медицинской помощи больным
дерматовенерологического
профиля, утвержденному
приказом Министерства
здравоохранения и социального
развития РФ
от 16 марта 2010 г. N 151н
1. Настоящее положение определяет организацию деятельности клинико-диагностической лаборатории (далее - Лаборатория).
2. Лаборатория является структурным подразделением медицинской организации, имеющей лицензию на оказание медицинской помощи, включая работы и услуги по специальности "дерматовенерология", "клиническая лабораторная диагностика", "бактериология", "лабораторная микология".
3. Лабораторию возглавляет заведующий, назначаемый на должность и освобождаемый от должности руководителем медицинской организации, в составе которой создана Лаборатория.
4. На должность заведующего Лабораторией назначается врач клинической лабораторной диагностики, врач - бактериолог, врач - лабораторный миколог, соответствующий Квалификационным требованиям к специалистам с высшим и послевузовским медицинским и фармацевтическим образованием в сфере здравоохранения, утвержденным приказом Минздравсоцразвития России от 7 июля 2009 г. N 415н (зарегистрирован Минюстом России 9 июля 2009 г. регистрационный номер N 14292), и имеющий стаж работы по данным специальностям не менее 5 лет в соответствии с приказом Минздравсоцразвития России от 23 июля 2010 г. N 541н (зарегистрирован Минюстом России 25 августа 2010 г. регистрационный N 18247).
5. На должности врача клинической лабораторной диагностики, врача - бактериолога, врача - лабораторного миколога Лаборатории назначаются специалисты, соответствующие Квалификационным требованиям к специалистам с высшим и послевузовским медицинским и фармацевтическим образованием в сфере здравоохранения, утвержденным приказом Минздравсоцразвития России от 7 июля 2009 N 415н (зарегистрирован Минюстом России 9 июля 2009 г. регистрационный N 14292), без предъявления требований к стажу работы в соответствии с приказом Минздравсоцразвития России от 23 июля 2010г. N 541н (зарегистрирован Минюстом России 25 августа 2010 г. регистрационный N 18247).
6. На должности фельдшера-лаборанта (медицинского лабораторного техника), лаборанта Лаборатории назначаются лица, подготовка которых соответствует требованиям квалификационных характеристик должностей, утвержденных приказом Минздравсоцразвития России от 23 июля 2010 г. N 541н (зарегистрирован Минюстом России 25 августа 2010 г. регистрационный N 18247).
7. Структура Лаборатории и штатная численность медицинского и другого персонала устанавливаются руководителем медицинской организации, в составе которой создана Лаборатория, исходя из объема проводимой лечебно-диагностической работы и численности обслуживаемого населения, с учетом рекомендуемых штатных нормативов согласно приложению N 6 к Порядку оказания медицинской помощи больным дерматовенерологического профиля, утвержденному настоящим приказом.
8. В структуре Лаборатории рекомендуется предусматривать следующие подразделения:
9. Оснащение Лаборатории оборудованием осуществляется в соответствии с видами проводимых исследований в соответствии со стандартами оснащения согласно приложению N 9 к Порядку оказания медицинской помощи больным дерматовенерологического профиля, утвержденному настоящим приказом.
10. Лаборатория осуществляет следующие функции:
проведение клинических лабораторных исследований больным дерматовенерологического профиля в объеме согласно заявленной номенклатуре исследований в соответствии с лицензией медицинской организации с целью оценки состояния пациента, уточнения диагноза, содействия в выборе адекватного лечения и контроля над его результатами;
обеспечение персонала клинических подразделений, занимающихся сбором биологического материала, инструкциями о правилах взятия, хранения и транспортировки биологического материала, гарантирующими стабильность образцов и надежность результатов исследований;
получение образцов биологического материала, пригодных для исследования;
проведение контроля качества лабораторных исследований путем систематического проведения внутрилабораторного контроля качества лабораторных исследований, а также участие в программах внешней оценки качества.
Приложение N 9
к Порядку оказания
медицинской помощи больным
дерматовенерологического
профиля, утвержденному
приказом Министерства
здравоохранения и социального
развития РФ
от 16 марта 2010 г. N 151н
* для клинико-диагностических лабораторий, создаваемых в научных или образовательных организациях, находящихся в ведении Минздравсоцразвития России.
Приказ Министерства здравоохранения и социального развития РФ от 29 сентября 2011 г. N 1087н "О внесении изменения в Порядок оказания медицинской помощи больным дерматовенерологического профиля, утвержденный приказом Министерства здравоохранения и социального развития Российской Федерации от 16 марта 2010 г. N 151н"
Зарегистрировано в Минюсте РФ 30 ноября 2011 г.
Регистрационный N 22459
Настоящий приказ вступает в силу по истечении 10 дней после дня его официального опубликования
Текст приказа официально опубликован не был
Обзор документаСкорректирован порядок оказания помощи больным дерматовенерологического профиля.
Уточнено, что ее можно получить в любых (в том числе частных) организациях, оказывающих медпомощь по профилю "дерматовенерология". В связи с этим вносятся соответствующие изменения.
Из числа указанных организаций исключены специализированные больницы и клиники медучреждений. Вместе с тем оказывать помощь больным дерматовенерологического профиля вправе не только клиники научных и образовательных организаций, но и их отделения. Также уточнено, что помощь предоставляется соответствующими стационарными отделениями (не только кожно-венерологическими).
Центрам специализированных видов медпомощи и лепрозориям рекомендуется организовывать свою деятельность так же, как в кожно-венерологических диспансерах. В указанных диспансерах, среди прочего, желательно создавать отделение для проведения медосмотров и клинико-диагностическую лабораторию.
Последняя может учреждаться и в других медорганизациях, оказывающих помощь больным дерматовенерологического профиля. Она проводит клинические лабораторные исследования. Цель - оценить состояние пациента, уточнить его диагноз, подобрать наиболее подходящее лечение, контролировать его результат. Также лаборатория получает образцы, пригодные для дальнейшего исследования, и обеспечивает персонал подразделений, занимающихся сбором биоматериала, инструкциями о правилах его взятия, хранения и транспортировки.
Лабораторию возглавляет заведующий - врач клинической лабораторной диагностики/врач-бактериолог/врач-лабораторный миколог. Он назначается на должность и отстраняется от нее руководителем медорганизации.
В лаборатории, в частности, рекомендовано создавать клинико-диагностическое, микробиологическое (бактериологическое), биохимическое, иммунохимическое (серологическое), молекулярно-биологическое отделения. Утвержден стандарт ее оснащения.
Скорректированы рекомендуемые нормативы численности персонала медорганизаций, оказывающих помощь больным дерматовенерологического профиля.
Для просмотра актуального текста документа и получения полной информации о вступлении в силу, изменениях и порядке применения документа, воспользуйтесь поиском в Интернет-версии системы ГАРАНТ:
ПОЛОЖЕНИЕ О КЛИНИКО-ДИАГНОСТИЧЕСКОЙ ЛАБОРАТОРИИ ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКОГО УЧРЕЖДЕНИЯ И ЦЕНТРАЛИЗОВАННОЙ КЛИНИКО-ДИАГНОСТИЧЕСКОЙ ЛАБОРАТОРИИ
1. Клинико-диагностическая лаборатория (в дальнейшем - КДЛ) является диагностическим подразделением лечебно-профилактического учреждения (ЛПУ) и создается на правах отделения.
2. Централизованные КДЛ создаются по указанию соответствующих территориальных органов управления здравоохранением для выполнения как различных видов исследований, так и одного их вида: биохимические, иммунологические, цитологические, микробиологические и другие исследования (специализированные лаборатории).
3. Организационная структура и порядок финансирования централизованных КДЛ устанавливается органом управления здравоохранением с учетом выполняемых ими задач и в соответствии с договором об участии лабораторий в осуществлении территориальных медицинских программ.
4. КДЛ, независимо от подчиненности и формы собственности, должна иметь сертификат на избранный вид деятельности.
5. Руководство КДЛ осуществляет заведующий, назначаемый и освобождаемый от должности руководителем учреждения здравоохранения в установленном порядке.
6. Деятельность КДЛ регламентируется соответствующими нормативными документами и настоящим положением.
7. Штаты КДЛ устанавливаются в соответствии с действующими нормативными документами с учетом местных условий или рассчитываются в соответствии с объемом работы.
8. Оснащение КДЛ осуществляется в соответствии с профилем и уровнем лечебно-профилактического учреждения.
9. КДЛ размещается в специально оборудованных помещениях, полностью соответствующих требованиям правил по устройству, эксплуатации и техники безопасности.
10. Нагрузка персонала определяется задачами лаборатории, положением о его функциональных обязанностях, а также расчетными нормами времени на проведение лабораторных исследований.
11. Основными задачами КДЛ являются: - проведение клинических лабораторных исследований в соответствии с профилем ЛПУ (общеклинических, гематологических, иммунологических, цитологических, биохимических, микробиологических и других, имеющих высокую аналитическую и диагностическую надежность) в объеме согласно заявленной номенклатуре исследований при аккредитации КДЛ в соответствии с лицензией ЛПУ. Объем выполняемых исследований не должен быть ниже минимального объема, рекомендуемого для ЛПУ данной мощности; - внедрение прогрессивных форм работы, новых методов исследований, имеющих высокую аналитическую точность и диагностическую надежность; - повышение качества лабораторных исследований путем систематического проведения внутрилабораторного контроля качества лабораторных исследований и участия в программе Федеральной системы внешней оценки качества (в дальнейшем - ФСВОК); - оказание консультативной помощи врачам лечебных отделений в выборе наиболее диагностически информативных лабораторных тестов и трактовке данных лабораторного обследования больных; - обеспечение клинического персонала, занимающегося сбором биологического материала, детальными инструкциями о правилах взятия, хранения и транспортировки биоматериала, обеспечивающими стабильность образцов и надежность результатов. Ответственность за точное соблюдение этих правил клиническим персоналом несут руководители клинических подразделений; - повышение квалификации персонала лаборатории; - проведение мероприятий по охране труда персонала, соблюдение техники безопасности, производственной санитарии, противоэпидемиологического режима в КДЛ; - ведение учетно-отчетной документации в соответствии с утвержденными формами.
12. В соответствии с указанными задачами КДЛ осуществляет: - освоение и внедрение в практику методов клинической лабораторной диагностики, соответствующих профилю и уровню лечебно-профилактического учреждения; - проведение клинических лабораторных исследований и выдачу по их результатам заключений.
13. КДЛ имеет право: - проводить на договорной основе лабораторные исследования для других ЛПУ; - участвовать в других системах внешней оценки качества клинических лабораторных исследований; - принимать участие в научных разработках, проводимых с использованием полученных в лаборатории данных (результаты исследований, полученные в лаборатории, являются ее интеллектуальной собственностью и не могут быть использованы без ее согласия).
Начальник Управления организации медицинской помощи населению А.И.ВЯЛКОВ
Приказ Минздрава РФ от 25.12.1997 N 380 "О состоянии и мерах по совершенствованию лабораторного обеспечения диагностики и лечения пациентов в учреждениях здравоохранения Российской Федерации" (вместе с "Положением о клинико-диагностической лаборатории лечебно-профилактического учреждения и централизованной клинико-диагностической лаборатории", "Положением о заведующем клинико-диагностической лабораторией", "Положением о враче клинической лабораторной диагностики", "Положением о биологе клинико-диагностической лаборатории", "Положением о медицинском технологе", "Положением о медицинском лабораторном технике", "Положением о лаборанте клинико-диагностической лаборатории", "Положением о главном внештатном специалисте по клинической лабораторной диагностике территориального органа управления здравоохранением", "Положением о территориальном организационно-методическом и контрольном центре по клинической лабораторной диагностике", "Положением о главном внештатном специалисте по клинической лабораторной диагностике территориального органа управления здравоохранением", "Положением о территориальном организационно-методическом и контрольном центре по клинической лабораторной диагностике", "Методикой расчета себестоимости лабораторного анализа")
Показать редакцию, действующую на дату:
Отметьте 2 редакции, чтобы сравнить их
Приказ Минздрава РФ от 25.12.1997 N 380 "О состоянии и мерах по совершенствованию лабораторного обеспечения диагностики и лечения пациентов в учреждениях здравоохранения Российской Федерации" (вместе с "Положением о клинико-диагностической лаборатории лечебно-профилактического учреждения и централизованной клинико-диагностической лаборатории", "Положением о заведующем клинико-диагностической ла.
Главная / 2008 / Апрель / 7 / Распоряжение Комитета по здравоохранению Правительства Санкт-Петербурга от 07.04.2008 N 166-р
Распоряжение Комитета по здравоохранению Правительства Санкт-Петербурга от 07.04.2008 N 166-р "Об утверждении Положения о межрайонной централизованной клинико-диагностической лаборатории"Документ по состоянию на август 2014 г.
В соответствии с приказом Минздрава России от 25.12.1997 N 380 "О состоянии и мерах по совершенствованию лабораторного обеспечения диагностики и лечения пациентов в учреждениях здравоохранения Российской Федерации", постановлением Правительства Санкт-Петербурга от 07.12.2004 "О Концепции модернизации системы здравоохранения Санкт-Петербурга на 2004-2010 годы", Концепцией реформирования службы клинической лабораторной диагностики в учреждениях здравоохранения Санкт-Петербурга на 2002-2010 годы, одобренной на заседании Правительства Санкт-Петербурга 26.06.2003 и в целях организации работы клинико-диагностических лабораторий в Санкт-Петербурге:
1.1. Положение о межрайонной централизованной клинико-диагностической лаборатории согласно приложению 1.
1.2. Требования, предъявляемые к техническому оснащению межрайонной централизованной клинико-диагностической лаборатории, согласно приложению 2.
1.3. Состав комиссии по проверке деятельности межрайонных централизованных клинико-диагностических лабораторий согласно приложению 3.
1.4. Положение о комиссии по проверке деятельности межрайонных централизованных клинико-диагностических лабораторий согласно приложению 4.
1.5. Перечень межрайонных централизованных клинико-диагностических лабораторий на 2008 год согласно приложению 5.
2. Заместителю председателя Комитета по здравоохранению Кадырову Ф.Н. подготовить для рассмотрения на тарифной комиссии вопрос о финансировании деятельности лабораторий, указанных в приложении 5.
3. Контроль за выполнением распоряжения возложить на первого заместителя председателя Комитета по здравоохранению Жолобова В.Е.
Председатель
Комитета по здравоохранению
Ю.А.Щербук
ПРИЛОЖЕНИЕ 1
к распоряжению Комитета
по здравоохранению
от 07.04.2008 N 166-р
1. Общие положения
1.1. Межрайонная централизованная клинико-диагностическая лаборатория (далее - МЦКДЛ) создается в целях организации работы клинико-диагностических лабораторий и является структурным подразделением учреждения здравоохранения, находящегося в ведении исполнительных органов государственной власти Санкт-Петербурга.
1.2. МЦКДЛ должна иметь соответствующую лицензию на выполнение биохимических, общеклинических, иммунохимических, серологических, цитологических, молекулярно-биологических и иных исследований.
1.3. Перечень МЦКДЛ определяется Комитетом по здравоохранению.
1.4. Организационная структура МЦКДЛ устанавливается исполнительными органами государственной власти Санкт-Петербурга, в ведении которых находится учреждение здравоохранения, с учетом выполняемых ими задач.
1.5. В своей деятельности МЦКДЛ руководствуется федеральным законодательством, законодательством Санкт-Петербурга и настоящим Положением.
1.6. Руководство МЦКДЛ осуществляет заведующий, назначаемый и освобождаемый от должности руководителем учреждения здравоохранения в установленном порядке.
2. Основные задачи
2.1. Проведение для всех обслуживаемых лечебно-профилактических учреждений (далее - ЛПУ) лабораторных исследований в объеме согласно номенклатуре исследований и лицензии.
2.2. Обеспечение специалистов ЛПУ информацией об используемых современных методах, оказание консультативной помощи специалистам ЛПУ.
2.3. Рациональное и эффективное использование современного измерительного и вспомогательного оборудования, реактивов и расходных материалов.
2.4. Повышение эффективности труда путем внедрения методов исследований, имеющих высокую аналитическую точность и эффективность.
2.5. Обеспечение качества лабораторных исследований путем систематического проведения внутрилабораторного контроля качества исследований и обязательного участия в системе внешней оценки качества исследований (СВОКИ).
2.6. Обеспечение инструкциями о правилах взятия, хранения и транспортировки биоматериала в зависимости от вида исследования.
2.7. Ответственность за точное соблюдение соответствующих правил взятия биоматериала клиническим персоналом процедурных кабинетов несут главные врачи ЛПУ.
2.8. Регулярное проведение мероприятий по охране труда персонала МЦКДЛ, соблюдению техники безопасности, производственной санитарии, противоэпидемиологического режима.
2.9. Соблюдение правил ведения необходимой документации, регламентирующей деятельность МЦКДЛ.
2.10. Своевременное представление отчетов о деятельности МЦКДЛ на бумажном и электронном носителях в Городской организационно-методический и контрольный отдел по клинической лабораторной диагностике, метрологии, аллергологии и иммунологии СПб ГУЗ "Медицинский информационно-аналитический центр".
3. Финансирование и типовое штатное расписание
3.1. Штатное расписание МЦКДЛ устанавливается главным врачом ЛПУ по согласованию с исполнительным органом государственной власти, в ведении которого находится ЛПУ, в соответствии с действующими нормативными документами, с учетом имеющегося оборудования, номенклатурой и объемом выполняемых исследований.
3.2. Финансирование МЦКДЛ осуществляется в соответствии с действующим законодательством.
4. Оснащение МЦКДЛ
4.1. МЦКДЛ размещается в специально оборудованных помещениях, полностью соответствующих требованиям правил по устройству, эксплуатации и техники безопасности.
4.2. МЦКДЛ должна быть оснащена:
- специально оборудованным помещением в соответствии с действующими ведомственными строительными нормами;
- основным и вспомогательным оборудованием, медикаментами, реактивами, контрольными, расходными и прочими материалами;
- спецодеждой и средствами защиты от контакта с биологическим материалом;
- лабораторной и прочей мебелью, хозяйственным инвентарем;
- специализированным, вспомогательным и общелабораторным оборудованием, компьютеризированными системами регистрации биоматериала и передачи результатов исследований.
5. Обязанности МЦКДЛ
5.1. Обеспечивать доставку материала транспортом МЦКДЛ в установленные сроки, его сохранность при транспортировке в соответствии с нормативными документами.
5.2. Контролировать преаналитическую стадию лабораторных исследований, своевременно информировать ЛПУ о допущенных нарушениях на данном этапе исследования.
5.3. Обеспечить ЛПУ инструкциями о правилах взятия, хранения и транспортировки биоматериала в зависимости от вида исследований.
5.4. Проводить внутрилабораторный контроль качества в полном соответствии с отраслевым стандартом "Правила проведения внутрилабораторного контроля качества количественных методов клинических лабораторных исследований с использованием контрольных материалов" ОСТ 91500.13.0001-2003.
5.5. Участвовать в системе внешней оценки качества клинических лабораторных исследований (ФСВОК и др.) по всем анализируемым параметрам.
5.6. Осваивать и внедрять в деятельность лаборатории современные методы лабораторной диагностики.
5.7. Повышать квалификацию персонала лаборатории.
5.8. Архивировать и хранить результаты исследований.
5.9. Своевременно доставлять результаты исследований врачам-клиницистам ЛПУ.
5.10. Своевременно передавать телефонограммой в соответствующие ЛПУ результаты патологических анализов, угрожающие жизни и здоровью пациента, требующие срочного принятия клинического решения.
5.11. Представлять необходимую информацию при проведении инспекционного контроля.
6.1. Проводить на договорной основе лабораторные исследования для любых лечебно-профилактических учреждений (ЛПУ) города, в том числе не относящихся к базовым (базовым специализированным) лечебно-профилактическим учреждениям, любой формы собственности и ведомственной подчиненности на основании соответствующего разрешения Комитета по здравоохранению.
6.2. Принимать участие в научных разработках, изысканиях и испытаниях, проводимых с использованием полученных в лаборатории данных.
6.3. Участвовать в иных (помимо ФСВОК) системах ВОК, в том числе и международных.
7. Контроль МЦКДЛ и порядок его проведения
7.1. Организацию и проведение контроля МЦКДЛ осуществляет комиссия по проверке деятельности межрайонных централизованных клинико-диагностических лабораторий, созданная Комитетом по здравоохранению. Состав комиссии и Положение о проведении контроля МЦКДЛ утверждаются Комитетом по здравоохранению.
7.2. Контроль МЦКДЛ проводится в целях проверки соблюдения лабораториями требований, установленных сроком лицензии, не реже одного раза в год.
7.2. Контроль обязателен для всех МЦКДЛ.
ПРИЛОЖЕНИЕ 2
к распоряжению Комитета
по здравоохранению
от 07.04.2008 N 166-р
I. Перечень специализированного обязательного оборудования для МЦКДЛ (базовый):
1. Гематологический анализатор с дифференцировкой лейкоцитарной формулы и счетом ретикулоцитов;
2. Проточный лазерный анализатор клеток;
3. Автоматизированная система для определения СОЭ;
4. Автоматический биохимический анализатор (Random access), производительность не менее 800 анализов в час;
5. Автоматический иммунохимический анализатор;
6. Коагулометр автоматический;
7. Автоматизированная система анализа мочи с микроскопией осадка;
8. Автоматизированная система для электрофореза белков (капиллярный электрофорез);
9. Анализатор электролитного состава крови (калий, натрий, ионизированный кальций);
10. Автоматизированная система для выделения нуклеиновых кислот;
11. Анализатор для ПЦР в режиме реального времени.
II. Лабораторная информационная система с компьютеризированной регистрацией биоматериала (рабочие места регистраторов ЛПУ), возможностью передачи информации заказчику, обеспечивающая контроль за проведением внутрилабораторного контроля качества, архивирование и хранение результатов исследований, создание различных отчетов (по требованию) о деятельности МЦКДЛ.
III. Вспомогательное оборудование:
в соответствии с перечнем вспомогательного оборудования, изложенным в приложении 8 приказа Минздрава РФ от 25 декабря 1997 г. N 380 "О состоянии и мерах по совершенствованию лабораторного обеспечения диагностики и лечения пациентов в учреждениях здравоохранения Российской Федерации".
Рассмотрено и одобрено решением лабораторного совета от 18.02.2008.
ПРИЛОЖЕНИЕ 3
к распоряжению Комитета
по здравоохранению
от 07.04.2008 N 166-р
ПРИЛОЖЕНИЕ 4
к распоряжению Комитета
по здравоохранению
от 07.04.2008 N 166-р
1. Общие положения
1.1. Комиссия по проверке межрайонных централизованных клинико-диагностических лабораторий создается в целях осуществления проверки соблюдения лабораториями требований, установленных сроком лицензии.
1.2. Состав комиссии и Положение о комиссии по проведению проверки межрайонных централизованных клинико-диагностических лабораторий утверждаются Комитетом по здравоохранению.
1.3. Комиссия несет ответственность за соблюдение порядка проведения контроля, объективность выводов при формировании заключений о деятельности лабораторий и уровня их технической компетентности.
2. Порядок проведения контроля
2.1. Комиссия по проверке межрайонных централизованных клинико-диагностических лабораторий определяет дату проведения контроля, согласовав ее с руководителем МЦКДЛ.
2.2. В целях проведения контроля комиссия по проверке межрайонных централизованных клинико-диагностических лабораторий запрашивает у МЦКДЛ следующие материалы:
- положение о МЦКДЛ;
- руководство по качеству;
- протоколы результатов исследований, которые МЦКДЛ выдала заказчикам за период с момента организации или последнего контроля;
- копии документов о результатах внешнего (ФСВОК и, если имеются, другие) и внутрилабораторного контроля качества результатов исследований в лаборатории за 12 месяцев, предшествующих контролю;
- разрешение Госкомсанэпиднадзора на работу с патогенными возбудителями;
- копию договора аренды средств измерений и другого оборудования (при использовании арендуемого оборудования);
- план-график проведения периодических поверок средств измерения;
- акты поверки применяемых средств измерения;
- должностные инструкции, сведения о квалификации персонала и формах ее повышения;
- информацию об изменениях в паспорте лаборатории, отражающую изменения в деятельности лаборатории, произошедшие с момента предшествующего контроля, а также о количестве выполненных исследований и реактивов по объемам и видам исследований в течение периода между датой предыдущего и настоящего контроля;
- контрольные диаграммы и(или) другую документацию по внутрилабораторному контролю качества.
Указанные материалы направляются в комиссию не позднее чем за две недели до начала работы.
2.3. Комиссия рассматривает представленные документы и изучает фактические показатели деятельности МЦКДЛ лаборатории, касающиеся:
- наличия квалифицированного персонала;
- наличия оборудования, средств измерений, в том числе стандартных образцов, аттестованных смесей, вспомогательного оборудования, обеспечивающих надежное выполнение заявленных видов деятельности;
- своевременности проведения поверок используемых средств измерений;
- наличия высококачественных наборов реактивов, калибровочных и контрольных материалов, а также других химических реактивов, необходимых для проведения исследований;
- наличия на каждом рабочем месте инструкций, необходимых для проведения исследований и процедур;
- наличия эффективной системы внутрилабораторного обеспечения и контроля качества исследований;
- участия во внешнем контроле качества, осуществляемом Федеральной системой внешней оценки качества клинических лабораторных исследований;
- наличия инструкций по технике безопасности и производственной санитарии;
- соответствия помещений и условий работы МЦКДЛ требованиям органов государственного санитарно-эпидемиологического надзора, государственного пожарного надзора, правилам техники безопасности.
2.4. Комиссия проверяет действительность на момент проведения контроля других документов, представленных лабораторией:
- ранее выданных сертификатов и лицензий;
- сертификатов сотрудников, обеспечивающих выполнение заявленных видов деятельности;
- гигиенического заключения органов государственного санитарного надзора;
- заключения органов государственного пожарного надзора;
- заключения вышестоящих органов надзора по вопросам охраны труда и техники безопасности.
3. Выводы комиссии по результатам контроля и их оформление
3.1. По результатам проведения каждого контроля составляется акт.
3.2. При выявлении нарушений, не отразившихся на достоверности результатов исследований, должны быть назначены мероприятия по их устранению с указанием конкретных сроков.
3.3. При серьезных нарушениях, ставящих под сомнение достоверность результатов исследований, выполняемых МЦКДЛ, комиссия рекомендует в зависимости от серьезности нарушений:
- приостановить полномочия МЦКДЛ;
- сузить область ее деятельности до устранения отмеченных нарушений;
- отменить полномочия МЦКДЛ.
3.4. При нарушении лабораторией сроков устранения недостатков, отмеченных в акте контроля, комиссия вправе приостановить полномочия МЦКДЛ.
3.5. Акт по результатам контроля доводится до сведения руководства МЦКДЛ.
3.6. На основании результатов комиссия принимает окончательное решение подтвердить полномочия, приостановить полномочия, сузить область деятельности МЦКДЛ.
3.7. О принятых решениях комиссия извещает заведующего лабораторией, руководство учреждения, в состав которого входит лаборатория, и Комитет по здравоохранению;
3.8. Информацию о сужении области распространения, отмене действия либо приостановке полномочий МЦКДЛ комиссия в трехдневный срок направляет в Комитет по здравоохранению для оформления соответствующих документов;
приостановленные полномочия могут быть возобновлены после устранения причин, вызвавших его приостановку; если эти причины не устраняются в течение срока приостановки, полномочия аннулируются.
3.9. Результаты контроля являются основанием для:
- подтверждения соответствия МЦКДЛ предъявляемым требованиям;
- продления срока полномочий МЦКДЛ (при положительных результатах инспекционного контроля);
- отмены или приостановки полномочий по всей области деятельности или в отдельных ее разделах (при отрицательных результатах контроля).
ПРИЛОЖЕНИЕ 5
к распоряжению Комитета
по здравоохранению
от 07.04.2008 N 166-р
1. СПб ГУЗ "Детская городская поликлиника N 71".
2. СПб ГУЗ "Городская поликлиника N 34".
3. СПб ГУЗ "Николаевская больница".
4. СПб ГУЗ "Консультативно-диагностический центр N 85".
5. СПб ГУЗ "Городская больница N 20".
6. СПб ГУЗ "Городская поликлиника N 87".
7. СПб ГУЗ "Городской диагностический центр N 1".
8. СПб ГУЗ "Консультативно-диагностический центр для детей".
9. СПб ГУЗ "Городская поликлиника N 91".
10. СПб ГУЗ "Городская поликлиника N 106".
11. СПб ГУЗ "Городская поликлиника N 107".
12. СПб ГУЗ "Городская больница N 33".
13. СПб ГУЗ "Консультативно-диагностическая поликлиника N 1 Приморского района".
14. СПб ГУЗ "Центр планирования семьи и репродукции".
15. СПб ГУЗ "Городская больница N 40 Курортного административного района".
КалендарьНиколаевская больница оказывает платные услуги населению диагностики и лечения по всем. Приказ минздрава рсфср от 132 о совершенствовании службы лучевой диагностики. Положение. Исследований для выявления кислотоустойчивых микобактерий в клинико. Инструкция ввк и мед.освидетельствование овд и вв мвд. Мвд n 523.


Главная документы о действующих нормативно-правовых и ведомственных документах по вич. Оглавление. Примечание рцпи! Порядок введения в действие кодекса рк см. Ст.186. Первые три уровня психики имеют следующие характеристики 1) формируются под влиянием. Г гааба дистрофия (о. Haab, 1850-1931, швейц. Офтальмолог) - см. Диммера болезнь гааба рефлекс (о.). Предисловие глава i. Общие положения статья 1. Государственная судебно-экспертная. Николаевская больница оказывает платные услуги населению диагностики и лечения по всем. Приказ минздрава рсфср от 132 о совершенствовании службы лучевой диагностики.

Положение. Исследований для выявления кислотоустойчивых микобактерий в клинико. Инструкция ввк и мед.освидетельствование овд и вв мвд. Мвд n 523. 4.помочь пациенту занять высокое положение. Каждый образец. С диагностической. Оглавление. Примечание рцпи! Порядок введения в действие кодекса рк см. Ст.186. Г гааба дистрофия (о. Haab, 1850-1931, швейц. Офтальмолог) - см. Диммера болезнь гааба рефлекс (о.).
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРИКАЗ
от 25 декабря 1997 года N 380
УТВЕРЖДЕНО
приказом Минздрава России
от 25.12.97 N 380
1. Клинико-диагностическая лаборатория (в дальнейшем - КДЛ) является диагностическим подразделением лечебно-профилактического учреждения (ЛПУ) и создается на правах отделения.
2. Централизованные КДЛ создаются по указанию соответствующих территориальных органов управления здравоохранением для выполнения как различных видов исследований, так и одного их вида: биохимические, иммунологические, цитологические, микробиологические и другие исследования (специализированные лаборатории).
3. Организационная структура и порядок финансирования централизованных КДЛ устанавливается органом управления здравоохранением с учетом выполняемых ими задач и в соответствии с договором об участии лабораторий в осуществлении территориальных медицинских программ.
4. КДЛ, независимо от подчиненности и формы собственности, должна иметь сертификат на избранный вид деятельности.
5. Руководство КДЛ осуществляет заведующий, назначаемый и освобождаемый от должности руководителем учреждения здравоохранения в установленном порядке.
6. Деятельность КДЛ регламентируется соответствующими нормативными документами и настоящим положением.
7. Штаты КДЛ устанавливаются в соответствии с действующими нормативными документами с учетом местных условий или рассчитываются в соответствии с объемом работы.
8. Оснащение КДЛ осуществляется в соответствии с профилем и уровнем лечебно-профилактического учреждения.
9. КДЛ размещается в специально оборудованных помещениях, полностью соответствующих требованиям правил по устройству, эксплуатации и техники безопасности.
10. Нагрузка персонала определяется задачами лаборатории, положением о его функциональных обязанностях, а также расчетными нормами времени на проведение лабораторных исследований.
11. Основными задачами КДЛ являются:ведение учетно-отчетной документации в соответствии с утвержденными формами.
12. В соответствии с указанными задачами КДЛ осуществляет:
- освоение и внедрение в практику методов клинической лабораторной диагностики, соответствующих профилю и уровню лечебно-профилактического учреждения;
- проведение клинических лабораторных исследований и выдачу по их результатам заключений.
13. КДЛ имеет право:Начальник Управления организации медицинской помощи населению